В настоящее время в лаборатории реализуется научно-исследовательский проект целью которого является идентификация и изучение работы генов, определяющих параметры моторного паттерна локомоции и звукопродукции Drosophila melanogaster.
Актуальность
Исследование нервных механизмов генерации ритмических движений является необходимым для лечения моторных дисфункций и восстановления утерянной двигательной активности в результате повреждений нервной системы (Gordon et al., 2006; Pearson, 2000). Несмотря на определенные успехи в изучении генераторов моторного паттерна на человеке и других млекопитающих (Goulding, Pfaff, 2005; Kiehn, Butt, 2003), исследования механизмов их работы на молекулярно-клеточном уровне в составе нейронных ансамблей продвигаются крайне медленно и находятся на начальной стадии. Drosophila melanogaster обладает простой нервной системой, является модельным объектом, для которого разработаны уникальные по своим возможностям генетические методы. Поэтому ее использование может внести значительный вклад в исследование механизмов реализации моторных функций, в частности, механизмов функционирования и управления работой центральных генераторов моторного паттерна (ЦГМП). Наличие сходства на молекулярном уровне в функционировании нервной системы позвоночных и насекомых (Fradkin et al., 2010; Marder, Bucher, 2001) позволяет переносить выявленные закономерности на более сложные объекты.Исследование нервных структур и групп нейронов, чья активность связана с генерацией и регуляцией моторного паттерна локомоторных и других ритмических актов у дрозофилы, ведется достаточно давно (Clyne, Miesenböck., 2008; Martin et al., 1998; Schlichet, Hall, 1979; Strauss, 2002; Strauss, Heisenberg, 1990; Suster, Bate, 2002; Suster et al., 2003). Однако данные о молекулярных механизмах работы ЦГМП носят лишь фрагментарный характер (Banerjee et al., 2004). В такой ситуации является продуктивным использование скрининга мутантных линий с фенотипическими отклонениями от нормы (Moran, Kyriacou, 2009; Landis et al., 2003; Strauss, 2002; Venken, Bellen, 2007) с последующей идентификацией и изучением экспрессии конкретных генов.
Реализация проекта
 Первым этапом в реализации проекта явилось создание коллекции мутантных линий (более 1000 линий) , содержащих в геноме вставку P-элемента (PdL-транспозона).
Первым этапом в реализации проекта явилось создание коллекции мутантных линий (более 1000 линий) , содержащих в геноме вставку P-элемента (PdL-транспозона).
 Структура модифицированного Р-элемента Ponce de Leon (PdL). 5’ и 3’- концевые последовательности Р-элемента необходимые для транспозиции обозначены заштрихованными прямоугольниками. Показаны сайт рестрикции Taq1 и праймеры, используемые в инвертированной ПЦР для амплификации фланговой геномной последовательности ДНК со стороны 3’-конца транспозона. Масштабы не соблюдены.
Структура модифицированного Р-элемента Ponce de Leon (PdL). 5’ и 3’- концевые последовательности Р-элемента необходимые для транспозиции обозначены заштрихованными прямоугольниками. Показаны сайт рестрикции Taq1 и праймеры, используемые в инвертированной ПЦР для амплификации фланговой геномной последовательности ДНК со стороны 3’-конца транспозона. Масштабы не соблюдены.
Самцы мутантных линий тестировались на наличие отклонений в параметрах локомоторного поведения и песни ухаживания от соответствующих параметров у самцов дикого типа (Canton-S, CS). Пример одночасовой записи траектории движения (локограммы) самцов дрозофилы, помещенных по одной особи в каждую из 10 камер.
По результатам поведенческого тестирования из коллекции Р-инсерционных мутантов дрозофилы были отобраны 22 линии с ярко выраженными и воспроизводимыми отклонениями по параметрам локомоторной активности и песни ухаживания при сравнении с линией дикого типа CS.
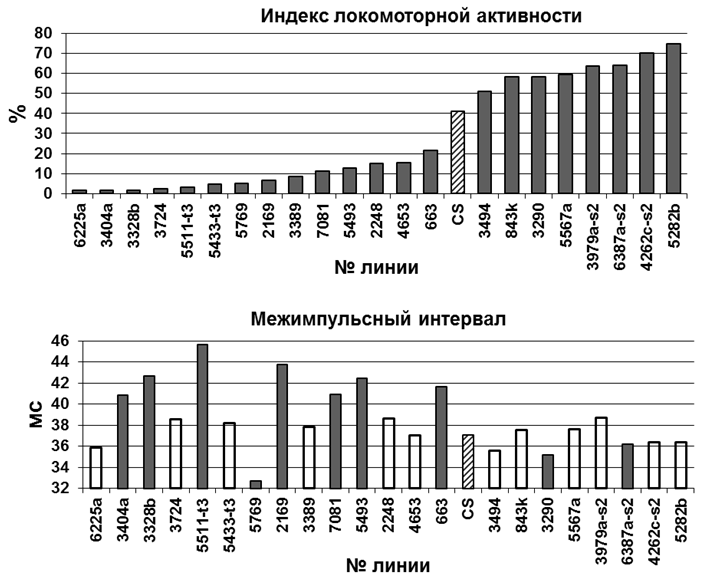 Пример результатов тестирования локомоторной активности и импульсной песни 22 мутантных линий в сравнении с линией дикого типа CS (заштрихованный столбик). На графиках представлены средние значения. Достоверно отличные значения выделены серым (тест рандомизации, 10000 итераций, Р<0,05). Индекс двигательной активности – время, занятое локомоцией, %.
Пример результатов тестирования локомоторной активности и импульсной песни 22 мутантных линий в сравнении с линией дикого типа CS (заштрихованный столбик). На графиках представлены средние значения. Достоверно отличные значения выделены серым (тест рандомизации, 10000 итераций, Р<0,05). Индекс двигательной активности – время, занятое локомоцией, %.
 Для выделенных по отклонениям в моторной активности мутантных линий определены локализация и направленность PdL-транспозона в геноме. Каждая из 22 проанализированных линий имела уникальную точку инсерции PdL-транспозона. В 14 случаях вставка транспозона произошла в некодирующих участках в начале генов Cf2, Dpg-1, Ext2, lola, MESR4, Map205, Mef2, Sps2, Treh, wdp, yps, CG5807, CG6746, CG15630; в двух случаях в кодирующей области генов jumu, CG8708; в одном случае в кластере транспозонов в перицентромерной области; в пяти остальных случаях в той или иной степени удаленности от 5’-конца генов drl, jing, mir-8, olf413, Hsrω.
Для выделенных по отклонениям в моторной активности мутантных линий определены локализация и направленность PdL-транспозона в геноме. Каждая из 22 проанализированных линий имела уникальную точку инсерции PdL-транспозона. В 14 случаях вставка транспозона произошла в некодирующих участках в начале генов Cf2, Dpg-1, Ext2, lola, MESR4, Map205, Mef2, Sps2, Treh, wdp, yps, CG5807, CG6746, CG15630; в двух случаях в кодирующей области генов jumu, CG8708; в одном случае в кластере транспозонов в перицентромерной области; в пяти остальных случаях в той или иной степени удаленности от 5’-конца генов drl, jing, mir-8, olf413, Hsrω.
 Получение методом инвертированной полимеразно-цепной реакции фрагментов геномной ДНК, которые содержат фланговую последовательность, примыкающую к месту вставки PdL-транспозона.
Получение методом инвертированной полимеразно-цепной реакции фрагментов геномной ДНК, которые содержат фланговую последовательность, примыкающую к месту вставки PdL-транспозона. Секвенирование полученных для каждой мутантной линии амплифицированных фрагментов геномной ДНК, которые содержат фланговую последовательность, примыкающую к месту вставки PdL-транспозона
Секвенирование полученных для каждой мутантной линии амплифицированных фрагментов геномной ДНК, которые содержат фланговую последовательность, примыкающую к месту вставки PdL-транспозона Определение локализации и направленности PdL-транспозона в геноме по базам данных и поисковым программам интернет-ресурсов FlyBase, NCBI
Определение локализации и направленности PdL-транспозона в геноме по базам данных и поисковым программам интернет-ресурсов FlyBase, NCBI
На основе анализа существующих экспериментальных и биоинформационных данных по генам, затронутым вставкой PdL-транспозона (интернет-ресурсы FlyBase, NCBI), были определены или предположены функции продуктов этих генов и их роль в функционировании организма. Больше половины затронутых мутациями генов кодирует факторы транскрипции и трансляции (8 генов) и рецепторные компоненты в мембранах клетки (4 гена). Также в группу генов, чья работа влияет на параметры моторного паттерна, вошли гены двух регуляторных РНК-молекул, белка MAP205, связанного с микротрубочками, двух гликозилтрансфераз и других ферментов клеточного метаболизма. Эти данные в сумме с анализом отклонений моторной активности позволили выделить для дальнейшего изучения гены, мутации в которых предположительно приводят к нарушениям в работе генераторов моторного паттерна (Федотов, 2010).
Локализация PdL-транспозона в геноме у четырех мутантных линий и краткое описание генов-кандидатов, нарушение функций которых может отвечать за наблюдаемые отклонения моторного поведения
В обозначении положения инсерции и направленности PdL-транспозона цифры 2 и 3 обозначают вторую или третью хромосомы, буквы R и L – правое или левое плечо соответствующей хромосомы, многозначное число – номер нуклеотида следующего за инсерцией, for и rev – направленность 3’-конца транспозона к окончанию нумерации нуклеотидов в хромосоме или к ее началу. Линия Положение инсерции и направленность PdL-транспозона Ген-кандидат Продукт гена Функция гена Локализация продукта гена в клетке Гомолог у человека 663 2R-5842843-rev Mef2 Предположительно транскрипционный фактор развитие скелетных, гладких и сердечных мышц, регуляция активности нейронов, определяющих суточные ритмы ядро MEF2A 5567a 3R-27894136-rev Map205 белок, связывающий микротрубочки участие в ремоделировании тубулиновой сети при митозе цитоплазма MAP4 3404а 2L- 4793956- for CG15630 Предположительно рецепторный компонент плазматической мембраны --- --- PALLD 5769 2L-10342643-for Sps2 Предположительно синтетаза моноселенофосфата синтез селеноцистеина цитоплазма SEPHS2
Действие мутаций генов, отобранных по результатам нашей работы, в той или иной степени распространяется на функционирование всех систем органов. Для подтверждения вовлеченности гена в нервные механизмы генерации моторного паттерна начато тестирование двигательной активности линий дрозофилы с нарушенной экспрессией генов-кандидатов в центральной нервной системе животного (ЦНС). 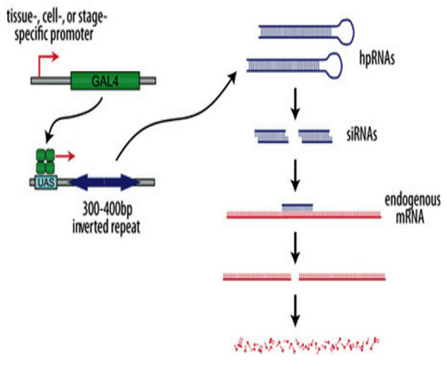 К настоящему моменту проведены первые эксперименты с локальным нокдауном генов CG15630 и sps2 в ЦНС дрозофилы. Супрессия генов-кандидатов осуществлялось посредством синтеза интерферирующей РНК через систему GAL4/UAS (Duffy, 2002). Эффективность работы системы GAL4/UAS была подтверждена в экспериментах с активацией экспрессии флуоресцентного белка GFP.
К настоящему моменту проведены первые эксперименты с локальным нокдауном генов CG15630 и sps2 в ЦНС дрозофилы. Супрессия генов-кандидатов осуществлялось посредством синтеза интерферирующей РНК через систему GAL4/UAS (Duffy, 2002). Эффективность работы системы GAL4/UAS была подтверждена в экспериментах с активацией экспрессии флуоресцентного белка GFP.
 Пример экспрессии флуоресцентного белка GFP под управлением промотора гена elav в системе GAL4/UAS (нижний ряд). Фото эмбрионов дрозофилы на последних стадиях развития перед вылуплением личинки. Экспрессия GFP наблюдается в мозге и брюшной цепочке. В верхней строке показаны контрольные родительские линии, содержащие в геноме конструкцию с белком GFP, который в отсутствие GAL4 не экспрессируется (обнаруживается лишь слабая флуоресценция желтка в кишечнике). Слева в нижнем ряду родительская линия, экспрессирующая GAL4 под управлением промотора гена elav.
Пример экспрессии флуоресцентного белка GFP под управлением промотора гена elav в системе GAL4/UAS (нижний ряд). Фото эмбрионов дрозофилы на последних стадиях развития перед вылуплением личинки. Экспрессия GFP наблюдается в мозге и брюшной цепочке. В верхней строке показаны контрольные родительские линии, содержащие в геноме конструкцию с белком GFP, который в отсутствие GAL4 не экспрессируется (обнаруживается лишь слабая флуоресценция желтка в кишечнике). Слева в нижнем ряду родительская линия, экспрессирующая GAL4 под управлением промотора гена elav.
 Уровень экспрессии генов-кандидатов оценивался методом количественной ПЦР. Было показано, что снижение уровня экспрессии генов CG15630 и sps2 в нервной системе приводит к изменению длительности побежек дрозофилы.
Уровень экспрессии генов-кандидатов оценивался методом количественной ПЦР. Было показано, что снижение уровня экспрессии генов CG15630 и sps2 в нервной системе приводит к изменению длительности побежек дрозофилы.
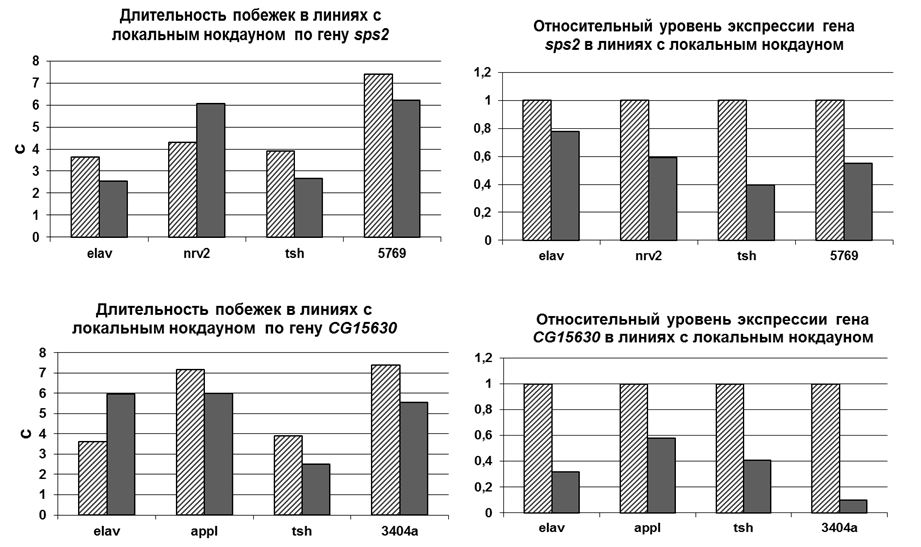 Оценка длительности побежки и уровня экспрессии для линий с локальным нокдауном генов CG15630 и sps2 под контролем промоторов генов elav, appl, nrv, tsh, а также линии, содержащей Р-инсерцию в генах-кандидатах (серые столбики). Значения показателей для контрольных линий показаны заштрихованными столбиками. Достоверность отличий подтверждена тестом рандомизации, 10000 итераций, Р<0,05.
Оценка длительности побежки и уровня экспрессии для линий с локальным нокдауном генов CG15630 и sps2 под контролем промоторов генов elav, appl, nrv, tsh, а также линии, содержащей Р-инсерцию в генах-кандидатах (серые столбики). Значения показателей для контрольных линий показаны заштрихованными столбиками. Достоверность отличий подтверждена тестом рандомизации, 10000 итераций, Р<0,05.
Наиболее интересным представляется снижение длительности побежек в линиях, в которых локализация интерференции управляется с промотора гена tsh. Данный ген преимущественно синтезируется в торакальных ганлиях ЦНС дрозофилы (Chintapalli et al., 2007), где непосредственно происходит генерация моторного паттерна локомоции и звукопродукции (см. обзоры Büschges et al., 2007; Tauber, Eberl, 2003 ).
Ожидаемые результаты
Завершение тестирования локомоторной активности и звукопродукции линий дрозофилы с локальным нокдауном генов-кандидатов CG15630, sps2, Mef2, Mар205 в различных отделах нервной системы на разных этапах развития позволит определить характер влияния генов-кандидатов на параметры двигательной активности и выбрать для дальнейшего исследования целевой ген, который с наибольшей вероятностью участвует в формировании генераторов моторного паттерна и/или непосредственно в генерации моторного выхода.  По данному гену планируется провести ряд экспериментов с использованием лазерного конфокального микроскопа для определение нервных структур, в которых экспрессируются целевой ген и в которых обнаруживаются нейроанатомические дефекты у мутантов по этому гену.
По данному гену планируется провести ряд экспериментов с использованием лазерного конфокального микроскопа для определение нервных структур, в которых экспрессируются целевой ген и в которых обнаруживаются нейроанатомические дефекты у мутантов по этому гену.
Освоены некоторые методs необходимые для реализации поставленных задач: получение образцов ЦНС дрозофилы и последующее окрашивание нервной системы иммуногистохимическими методами Трехмерное изображение препарата ЦНС дрозофилы, полученное на лазерном конфокальном микроскопе Zeiss LSM710. Вид сбоку и вид сверху, а также фото ЦНС в проходящем свете. Использованы флуоресцентные красители. Зеленым окрашены структуры нейропиля (первичные антитела ab49/92, Jackson ImmunoResearch к белку CSP, cysteine string protein; вторичные антитела Donkey anti-Mouse IgG, Abcam, конъюгированные с флуоресцеин изотиоционатом) , синим – клеточные тела, окружающие нейропиль (краситель DAPI).
Трехмерное изображение препарата ЦНС дрозофилы, полученное на лазерном конфокальном микроскопе Zeiss LSM710. Вид сбоку и вид сверху, а также фото ЦНС в проходящем свете. Использованы флуоресцентные красители. Зеленым окрашены структуры нейропиля (первичные антитела ab49/92, Jackson ImmunoResearch к белку CSP, cysteine string protein; вторичные антитела Donkey anti-Mouse IgG, Abcam, конъюгированные с флуоресцеин изотиоционатом) , синим – клеточные тела, окружающие нейропиль (краситель DAPI).
Итоги этой работы должны привести к пониманию роли целевого гена и его продуктов в механизме генерации моторного паттерна ритмических движений. Полученные данные будут использованы для разработки стратегии молекулярно-генетических исследований гомологов изученных генов-кандидатов в классе млекопитающих.
Работа поддержана подпрограммой «Генофонды и генетическое разнообразие» Президиума РАН и Федеральной целевой программой “Научные и научно-педагогические кадры инновационной России” на 2009 – 2013 годы.


